Únicos reimaginando el futuro
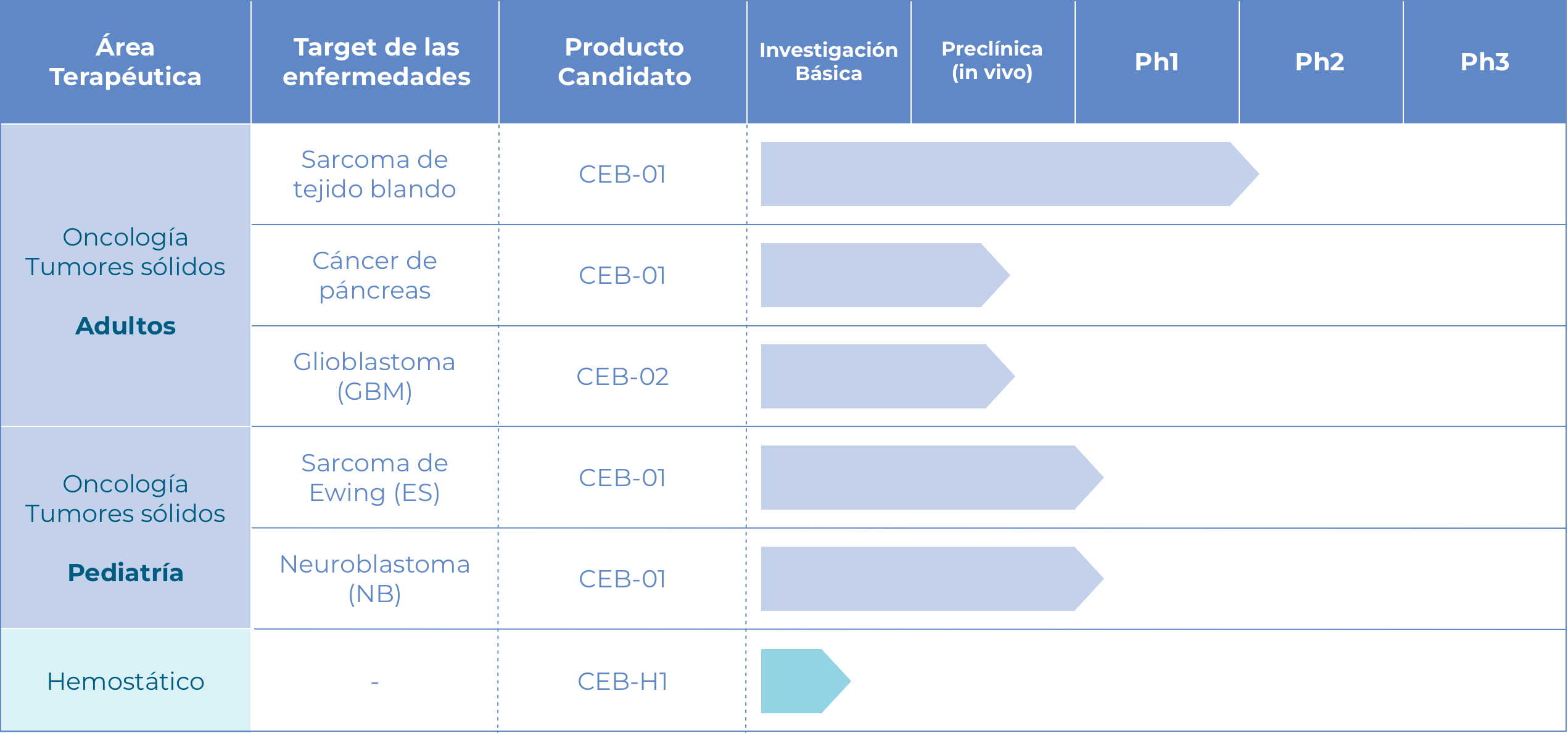
¿Qué hace único a CEB-01?

Es el primer sistema de control local para el sarcoma de tejidos blandos (STS, por sus siglas en inglés) cuya seguridad, tolerabilidad y eficacia han sido demostradas y validadas en estudios preclínicos regulatorios.
Los primeros resultados en la fase de desarrollo clínico, Fase I, muestran que los pacientes no presentaron toxicidad ni complicaciones postquirúrgicas asociadas a CEB-01.
Tenemos nuestra propia máquina de producción con certificación de buenas prácticas de fabricación (GMP, por sus siglas en inglés), y el proceso de producción y el producto final están certificados por GMP.
No hay otro producto como CEB-01 en el mercado.
Resultados ensayo clínico de Fase I CEB-01?
Se ha realizado el primer ensayo clínico en humanos (3+3, extensión a 21 pacientes) para determinar las dosis recomendadas y la seguridad y tolerancia de las membranas de PLGA CEB-01, en pacientes con sarcoma de tejidos blandos retroperitoneal recurrente o localmente avanzado, STS, después de la cirugía.
- 5 hospitales activos
- 12 pacientes: 4 mujeres y 8 hombres
- Media de edad de 62,1 años (rango de 40 a 77)
Tumor:
- Liposarcoma poco diferenciado: 5
- Liposarcoma bien diferenciado: 4
- Liposarcoma: 2
- Leiomiosarcoma: 1
5 son recurrencias y 7 son nuevos casos.
Conclusiones
Ensayo clínico de Fase I CEB-01
- CEB-01 es seguro y bien tolerado.
- No se ha observado toxicidad limitante de dosis en ninguna de las dosis.
- Los efectos adversos son similares a los posteriores a la cirugía de sarcomas.
- Recurrencia en el área de la membrana en 2 casos tratados con la dosis más baja.
- 5 pacientes sin recurrencia local durante 1-2 años.
